【概要】
・グリコシド結合を加水分解することでデンプンを分解する。
・「体内では主に、膵臓、耳下腺(唾液腺)から分泌される」(ウィキペディア)
・「ダイコンやカブ、ヤマイモにも多く含まれている。」(ウィキペディア)
【異性体】
「α-アミラーゼ、β-アミラーゼ、グルコアミラーゼやイソアミラーゼがある。 」(ウィキペディア)
【ヒトアミラーゼ】
「ウィキペディア」には「ヒトアミラーゼ」ということで以下のような一覧表が掲載されている。
| |
名 称 |
分泌器官 |
機 能 |
1 |
アルファ1A アミラーゼ |
唾液腺 |
デンプンの分解 |
2 |
アルファ1B アミラーゼ |
3 |
アルファ1C アミラーゼ |
4 |
アルファ2A アミラーゼ |
膵臓 |
5 |
アルファ2B アミラーゼ |
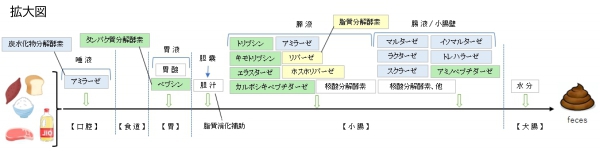
【タンパク質分解酵素一覧表】
⇒消化酵素一覧表
【ウィキペディア】
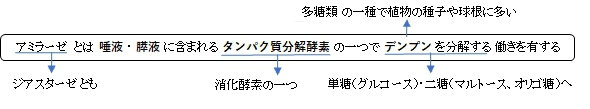
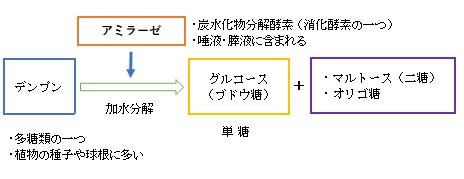
アミラーゼ (amylase)はジアスターゼとも称される、膵液や唾液に含まれる消化酵素。グリコシド結合を加水分解することでデンプン(ラテン語amylum)中のアミロースやアミロペクチンを、単糖類であるグルコースや二糖類であるマルトースおよびオリゴ糖に変換する酵素群である。
概要
アミラーゼは1833年、フランスの生化学者、アンセルム・ペイアン (Anselme Payen) とジャン・ペルソー (Jean F. Persoz) が大麦の芽から取り出し、「切り離す」を意味するギリシア語の “διαστασις” より「ジアスターゼ」(旧仮名でヂアスターゼ)と命名された。これが酵素の初めての単離である。現在、正式な物質名はアミラーゼである。旧名であるジアスターゼも医薬品のタカジアスターゼに含まれている。
アミラーゼは消化酵素であり、デンプンやグリコーゲンを分解する。体内では主に、膵臓、耳下腺(唾液腺)から分泌され、またダイコンやカブ、ヤマイモにも多く含まれている。胃腸薬、消化剤として市販もされ、胃もたれや胸焼けの治療、防止に服用されている。
タカジアスターゼ
日本の製薬会社三共の事実上の創業者である高峰譲吉は、麹菌からジアスターゼを抽出し、自身の名の「タカ」を冠してタカジアスターゼと命名して1894年(明治27年)に特許を申請した[1]。高峰のジアスターゼ(アミラーゼ)の抽出成功は古くから餅を食べるとき大根おろしをつけて食べると胃がもたれないと言う事が大きなヒントとなったとも伝えられる。
夏目漱石の作品『吾輩は猫である』には、佐伯矩が発見した大根ジアスターゼに関する新聞記事やタカジアスターゼを常用する人物が描写されて[2]、消化を促進するという機能が広く知られ用いられた様子がわかる。[3]。
日本では胃腸薬に含まれる。第一三共の医薬品「タカヂアスターゼ原末」として2021年まで販売された(主に解熱鎮痛剤や整腸剤など他の散剤と混合して使うが、処方箋医薬品ではないため零売が可能)。医薬品の「S・M配合散」に漢方薬と共に配合されている。また、第一三共ヘルスケアから一般用医薬品の「新タカヂア錠」と「第一三共胃腸薬」シリーズにタカヂアスターゼNとして配合されている。
異性体
α-アミラーゼ[4]、β-アミラーゼ[5]、グルコアミラーゼ[6]やイソアミラーゼ[7]がある。
α-アミラーゼ
α-アミラーゼは別名を1,4-α-D-グルカングルカノヒドロラーゼ、グリコゲナーゼといい、デンプンやグリコーゲンのα-1,4-結合を不規則に切断し、多糖ないしマルトース、オリゴ糖を生み出す酵素である。
β-アミラーゼ
β-アミラーゼは別名を1,4-α-D-グルカングルカノマルトヒドロラーゼ、グリコゲナーゼあるいはサッカロゲンアミラーゼといい、デンプンやグリコーゲンをマルトース(麦芽糖)に分解する。植物や微生物ではよく見られるが、動物からは見つかっていない。糖鎖の非還元末端から二つ目のα-1,4-グリコシド結合をエキソ型で逐次分解してマルトースを産生する。直鎖型のアミロースに対する分解効率は高い。一方、アミロペクチンに対してはα-1,6-グリコシド結合をしている分枝部で反応が停止し、マルトースとともにβリミットデキストリンが生成される。
グルコアミラーゼ
グルコアミラーゼは正式名称がグルカン1,4-α-グルコシダーゼといい、1,4-α-D-グルカングルコヒドロラーゼ、エキソ1,4-α-グルコシダーゼ、γ-アミラーゼ、リソソーマルα-グルコシダーゼあるいはアミログルコシダーゼを別名とする。糖鎖の非還元末端のα-1,4-結合をエキソ型に加水分解してブドウ糖1分子を産生する。α-1,6-結合も切断するものも知られている。
イソアミラーゼ
詳細は「イソアミラーゼ」を参照
イソアミラーゼはアミロペクチンやグリコーゲン中のα-1,6-グリコシド結合を切断して直鎖のデキストリンやアミロースを生産する。ただし、プルランを分解できない。分枝部を切断するため、枝切り酵素や脱分枝酵素とも呼ばれる。
利用
アミラーゼは、植物では果実の成熟や穀物の発芽の間に合成される。穀物酒や酢、水あめなどの伝統的な製法ではデンプンの糖化に麦芽に含まれるアミラーゼが用いられる。
微生物の分泌するアミラーゼは工業的に大量に生産され、製糖、食品加工、胃腸薬、衣料製造、洗剤等に利用されている。工業的にアミラーゼを生産する微生物としてはアスペルギルス・オリゼーや枯草菌が知られている。
尿中や血中のアミラーゼは、膵臓疾患や唾液腺疾患の診断に使われる。
ヒトアミラーゼ
ヒトのアミラーゼには以下のものがある。
酵素名 |
遺伝子 |
遺伝子座標 |
機能 |
アルファ1A アミラーゼ(唾液腺) |
AMY1A,EC 3.2.1.1 |
1 p21 |
澱粉の分解 |
アルファ1B アミラーゼ(唾液腺) |
AMY1B,EC 3.2.1.1 |
1 p21 |
澱粉の分解 |
アルファ1C アミラーゼ(唾液腺) |
AMY1C,EC 3.2.1.1 |
1 p21 |
澱粉の分解 |
アルファ2A アミラーゼ(膵臓) |
AMY2A,EC 3.2.1.1 |
1 p21 |
澱粉の分解 |
アルファ2B アミラーゼ(膵臓) |
AMY2B,EC 3.2.1.1 |
1 p21 |
澱粉の分解 |
医療においてアミラーゼ高値を呈していることは、必ずしも膵疾患(特に急性・慢性膵炎)、唾液腺疾患を意味しない。疾患を合併しない代表的なものとしてマクロアミラーゼ血症がある。これはアミラーゼと免疫グロブリンが複合体を形成し、血清アミラーゼを測定すると高値を呈するもので、臓器障害を意味しない。
同様の状態にはマクロクレアチンキナーゼ血症(マクロCK血症)がある。
https://ja.wikipedia.org/wiki/%E3%82%A2%E3%83%9F%E3%83%A9%E3%83%BC%E3%82%BC