【概 要】

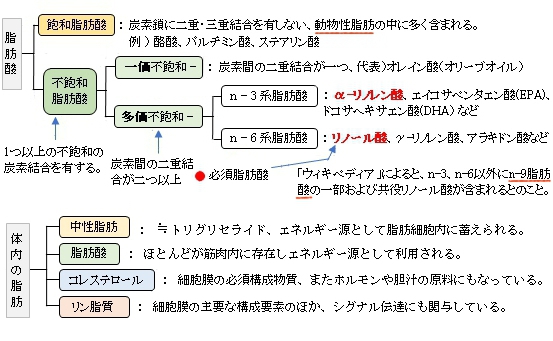
・「僅かに黄色を呈する油状物質(融点:-44℃) 」(ウィキペディア)
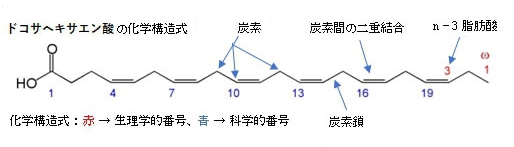
・6つの二重結合を含む22個の炭素鎖をもつカルボン酸 (22:6) の総称であるが、通常は生体にとって重要な 4, 7, 10, 13, 16, 19 位に全てシス型の二重結合をもつ、ω-3脂肪酸に分類される化合物を指す。「」(ウィキペディア)
・「エイコサペンタエン酸(EPA)やドコサペンタエン酸(DPA) とともに高度不飽和脂肪酸(PUFA) とも呼ばれている。 」(ウィキペディア)
・「動物組織では血液(血球・血漿)、脂肪組織に少なく、脳灰白質部、網膜、神経、心臓、精子、母乳中に多く含まれるが偏って存在している 」(ウィキペディア)

【働 き】
以下は「ウィキペディア」の解説文の一部となる。
精製純度が低い1980年代後半のDHA を利用した研究で下記の様な作用に関する報告がある[6]が、作用の解明は不十分であったと指摘されている[6]ほか、未だにメカニズムが解明されていない作用もある[18]。
- 学習機能向上作用(記憶改善、健脳作用)
- 制がん作用(特に乳がん、大腸がん、肺がん等)
- 血中脂質低下作用(コレステロール、中性脂肪)
- 網膜反射能向上作用(視力低下抑制) ※DHAは目の網膜の組織に多く含まれる。
- 血圧降下作用
- 抗血栓作用(血小板凝集抑制作用)
- 抗アレルギー作用
- 抗炎症作用
- 抗糖尿病作用(血糖値低下)
【多く含む食品】
魚類全般に含まれるが、特に魚の目の周囲の脂肪に多く、マグロの目では周囲の脂肪の約30%を占め
る。
【n-3系脂肪酸を多く含む食品】 (mg/100g) 参考サイト:「料理の王国」のHP
|
食品名 |
n-3系脂肪酸 |
EPA |
DHA |
1 |
さんま(皮なし刺身) |
6920 |
1500 |
2800 |
2 |
さば(開き干し) |
6780 |
2200 |
3100 |
3 |
ノルウェーさば(焼き) |
6500 |
1700 |
2700 |
4 |
しめさば |
6030 |
1600 |
2600 |
5 |
まいわし(缶詰・味付け) |
4230 |
1800 |
1400 |

【n-3系脂肪酸一覧表】
以下「ウィキペディア」を参考にして作成した一覧表になるが、n-3系の全てを収めているかどうかは不明。
【参考となるサイト】
以下は「ウィキペディア」の解説文となる。
ドコサヘキサエン酸(ドコサヘキサエンさん、Docosahexaenoic acid、略称:DHA)は、不飽和脂肪酸のひとつで、僅かに黄色を呈する油状物質。6つの二重結合を含む22個の炭素鎖をもつカルボン酸 (22:6) の総称であるが、通常は生体にとって重要な 4, 7, 10, 13, 16, 19 位に全てシス型の二重結合をもつ、ω-3脂肪酸に分類される化合物を指し、エイコサペンタエン酸(EPA)やドコサペンタエン酸(DPA) とともに高度不飽和脂肪酸(PUFA) とも呼ばれている。必須脂肪酸の一つ。
【
解説】
体内で合成できないα-リノレン酸を原料としてDHAを生合成するため、広義では必須脂肪酸となる[4]。動物組織では血液(血球・血漿)、脂肪組織に少なく、脳灰白質部、網膜、神経、心臓、精子、母乳中に多く含まれるが偏って存在している[5]。食品ではサバやイワシ、サンマ等の青魚の魚油に多く含まれ、日本人は魚類を食べることによって多く摂取していたが近年は減少している[6]。
生理活性効果に関して1980年代から積極的な研究が行われ、エイコサペンタエン酸と同様に食品添加物、養殖飼料[7]、健康補助食品[8]に利用されている[6][9]。
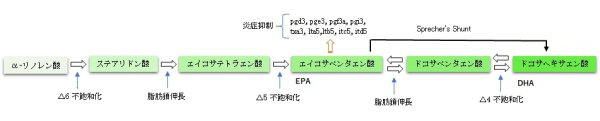
【生合成】
必須脂肪酸の代謝経路とエイコサノイドの形成
青魚やその他の生物に含まれるDHAの多くは、ラビリンチュラ類の1属である、Schizochytrium属などのような海産の微生物によって生産されたものが、食物連鎖の過程で濃縮されて出来たものである。
多くの動物は体内でα-リノレン酸を原料としてエイコサペンタエン酸やDHAを生合成することができるが、α-リノレン酸からEPAやDHAに変換される割合は10-15%程度である[10]。ヒトでは、DHAは食品から摂取する以外に、2つの経路によって生合成(代謝生産)される[11]。どちらも出発原料はα-リノレン酸であるが、中間生成物が異なる。
ひとつはエイコサペンタエン酸 (20:5, ω-3) を原料とし、エロンガーゼによって2炭素増炭されドコサペンタエン酸 (22:5 ω-3) がつくられた後、Δ4-不飽和化酵素によって水素が引き抜かれて生成する過程である。
もうひとつの経路は、ペルオキシソームあるいはミトコンドリア中で進行すると考えられているもので、エイコサペンタエン酸が2回2炭素増炭されて (24:5 ω-3) となった後、Δ6-不飽和化酵素により不飽和化されて (24:6 ω-3) となり、その後β酸化によって炭素鎖が切断されDHAが生成する。この経路はSprecher's shunt として知られている。
【摂取】
「日本人の食事摂取基準(2010年版)」ではエイコサペンタエン酸(EPA)やドコサヘキサエン酸については1日に合計で1g以上の摂取が望ましいとされている[12]。魚油食品、タラ、ニシン、サバ、サケ、イワシ、ナンキョクオキアミは、エイコサペンタエン酸やドコサヘキサエン酸のようなω-3脂肪酸に富んでいる。1日3g以上のDHAの摂取で、凝血能が低下し出血傾向が起きることがある[13]。
魚介類100g中の主な脂肪酸については魚介類の脂肪酸を参照のこと。
【生理作用】
細胞膜は流動性を持ち、脂質や膜タンパクは動いている。この流動性は膜の構成物質で決まる。たとえば、
リン脂質を構成する脂肪酸の不飽和度(二重結合の数)に影響され、二重結合を持つ炭化水素が多いほど(二重結合があるとその部分で炭化水素が折れ曲がるので)リン脂質の相互作用が低くなり流動性は増すことになる。例えばDHAは不飽和度が極めて高く細胞膜の流動性の保持に寄与している。
DHAは
精液や
脳、
網膜の
リン脂質に含まれる
脂肪酸の主要な成分である。DHAは脳内にもっとも豊富に存在する長鎖不飽和脂肪酸で、EPAは脳内にほとんど存在しない
[14]。これは投与されたEPAは脳内に移行したのち,速やかにDPAさらにはDHAに変換されるためであることが指摘されている
[15]。他方、ラットの動物実験で脳のリン脂質においてDHAを摂食すると脳リン脂質中のDHAの割合は増加したが、DPA及びEPAは摂食しても脳のリン脂質脂肪酸組成にはほとんど影響を及ぼさなかったことから、DHAは
脳関門を通過できるが、EPAを含めた他の
ω-3脂肪酸は脳関門を通過することができない可能性が示唆されている
[16]。また、ヒトのモデル細胞実験で各種脂肪酸によるDHA取り込みに対する阻害効果を検討した結果、
リノール酸、
アラキドン酸及びエイコサペンタエン酸(EPA)によって阻害され、
オレイン酸によって阻害されなかった。従って、DHAは何らかの脂肪酸選択的な輸送機構を介して取り込まれることが示唆されている
[17]。
【活性作用
】
精製純度が低い1980年代後半のDHA を利用した研究で下記の様な作用に関する報告がある
[6]が、作用の解明は不十分であったと指摘されている
[6]ほか、未だにメカニズムが解明されていない作用もある
[18]。
- 学習機能向上作用(記憶改善、健脳作用)
- 制がん作用(特に乳がん、大腸がん、肺がん等)
- 血中脂質低下作用(コレステロール、中性脂肪)
- 網膜反射能向上作用(視力低下抑制)
- 血圧降下作用
- 抗血栓作用(血小板凝集抑制作用)
- 抗アレルギー作用
- 抗炎症作用
- 抗糖尿病作用(血糖値低下)
DHAの摂取は血中の中性脂肪(トリグリセライド)量を減少させ、心臓病の危険を低減する。また、DHAが不足すると脳内セロトニンの量が減少し、多動性障害を引き起こすという報告がある[19]。アルツハイマー型痴呆[20][21]。一方で、DHA投与がアルツハイマー病の症状を改善しなかったとの報告がある[14]。また、ω-3脂肪酸を単独で大量に摂取しても特別な活性作用は得られず、ω-6脂肪酸との摂取バランスが重要と考えられているが、国際的に統一された比率に関する見解は無く各国が独自に定めている[4]。
【工業的生産】
人工合成は行われず高度不飽和脂肪酸(PUFA)を多く含む魚油、マグロ眼窩油、ユーグレナ藻などを原料として、分離精製のため様々な方法が検討されてきた。これらは化学的、物理的観点から以下のように分類できる[22]。
- PUFAを化学的反応を利用して分離する方法
- 酵素による選択的加水分解
- 酵素による選択的エステル化[23]
- 銀錯体形成
- 尿素包接形成
- ヨードラクトン化
- PUFA自体の物性で分離する方法
- 蒸留(精密蒸留、分子蒸留)
- 溶剤低温分別
- 低温分別結晶化
- PUFA媒体との相互作用で分離する方法
- クロマトグラフィ
- 膜分離抽出(液-液分配)
- 超臨界二酸化炭素[24]
特定成分のみを高効率・高濃度での分離抽出に特化した技術開発も行われ、成分の変質劣化を抑制するために窒素などの不活性ガス中で分離抽出を行ったり様々な方法が存在する。
【
うつ病と脂肪酸に関する議論】
詳細は「うつ病」を参照
うつ病が20世紀になって増加しているが、うつ病の増加とω-6脂肪酸を多く含む植物油の摂取が増加したこととの関連を指摘する意見[25]が幾つか見受けられる[26]。一方、日本の患者数の年度ごとの増加傾向には、高齢化やうつ病についての啓発活動による受診率の増加が原因としてあげられる[27]が解明は不十分である[26][28]。ω-3脂肪酸の摂取がうつ病の治療に効果があるか、日本でのエビデンスは希薄である[29]。
うつ病患者においてはω-6脂肪酸からアラキドン酸を経て生成される炎症性の生理活性物質であるエイコサノイドのレベルが高いということが示されている[30][31]。シーフードをたくさん摂取するところほど母乳内のDHAは高く、産後うつ病の有病率は低かった。母体から胎児への転送により、妊娠・出産期には母親には無視できないω-3脂肪酸の枯渇の危険性が高まり、その結果として産後のうつ病の危険性に関与する可能性がある。健常者と比較してうつ病患者はω-3脂肪酸の蓄積量が有意に低くω-6とω-3の比率は有意に高かったことが指摘されている[10]。