
・「エラスチンまたはそのほかのタンパク質を加水分解する反応を触媒する酵素」(化学事典)
・「ペプチド鎖中に存在する,中性アミノ酸のカルボキシル基側の酸アミド結合を加水分解する」(化学事典)
・「タンパク質を分解するプロテアーゼの分類の一つ」(ウィキペディア)
・「ヒトには8つのエラスターゼの遺伝子が存在する。 」(ウィキペディア)

以下は「ウィキペディア」の解説文となる。
エラスターゼ(Elastase)は、タンパク質を分解するプロテアーゼの分類の一つである[1]。
分類
ヒトには8つのエラスターゼの遺伝子が存在する。
ファミリー |
遺伝子 |
タンパク質 |
EC番号 |
酵素名[2] |
現在 |
以前 |
現在 |
以前 |
chymotrypsin-
like |
CELA1 |
ELA1 |
chymotrypsin-like elastase family, member 1 |
elastase 1, pancreatic |
EC 3.4.21.36 |
膵臓エラスターゼ |
CELA2A |
ELA2A |
chymotrypsin-like elastase family, member 2A |
elastase 2A, pancreatic |
EC 3.4.21.71 |
膵エラスターゼII |
CELA2B |
ELA2B |
chymotrypsin-like elastase family, member 2B |
elastase 2B, pancreatic |
EC 3.4.21.71 |
CELA3A |
ELA3A |
chymotrypsin-like elastase family, member 3A |
elastase 3A, pancreatic |
EC 3.4.21.70 |
膵エンドペプチダーゼE |
CELA3B |
ELA3B |
chymotrypsin-like elastase family, member 3B |
elastase 3B, pancreatic |
EC 3.4.21.70 |
chymotrypsin |
CTRC |
ELA4 |
chymotrypsin C (caldecrin) |
elastase 4 |
EC 3.4.21.2 |
キモトリプシンC |
neutrophil |
ELANE |
ELA2 |
neutrophil elastase |
elastase 2 |
EC 3.4.21.37 |
顆粒球エラスターゼ |
macrophage |
MMP12 |
HME |
macrophage metalloelastase |
macrophage elastase |
EC 3.4.24.65 |
マクロファージエラスターゼ |
緑膿菌のような細菌もエラスターゼを生産するが、毒性の要因になっていると考えられている。
機能
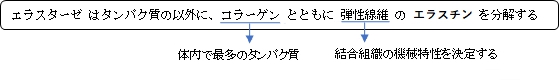
エラスターゼは、コラーゲンとともに結合組織の機械特性を決定している弾性繊維のエラスチンを分解する。好中球の形で、大腸菌やその他のグラム陰性菌のOuter membrane protein A(OmpA)を分解する。またペプチド結合を切断することで赤痢菌の毒性も分解する。C末端側のグリシン、アラニン、バリン等の小さな疎水的アミノ酸の位置が切断される。それ以外の詳しい機構については、セリンプロテアーゼを参照のこと。
病気におけるヒトのエラスターゼの役割
A1AT
急性期タンパク質のα1-アンチトリプシンは、エラスターゼやトリプシンの活性部位にほぼ不可逆的に結合することでエラスターゼの働きを阻害する。A1ATは通常は肝臓から血清に分泌される。α1-アンチトリプシン欠損症(A1AT)では、エラスターゼによるエラスチンの分解が阻害されず、肺気腫等を引き起こす。
周期性好中球減少症
周期性好中球減少症は珍しい病気で、好中球の数が21日ごとに増減する常染色体優性遺伝病である。好中球が減少する期間は、患者は感染に弱い。1999年に、この病気はELA-2 / ELANE遺伝子の異常と関連があることが発見された[3]。またELA-2遺伝子の変異でもこの病気が起こることが分かっている。
その他の病気
抗体の存在下で、好中球のエラスターゼが水疱を形成し、類天疱瘡を引き起こす。
病気における細菌のエラスターゼの役割
エラスターゼは密着結合を分裂させ、サイトカインやαプロテイナーゼ阻害剤を分解し、免疫グロブリンA(IgA)及び免疫グロブリンG(IgG)を切断し、また補体を構成するC3biや食作用に関わる別の補体の受容体CR1も切断する。IgA、IgG、C3bi、CR1の切断によって、好中球が食作用によって細菌を殺す能力が減少する。また、これらの因子はヒトの病状にも関わっている。
